近期,中科院合肥研究院强磁场科学中心王俊峰研究员课题组在深入理解生物矿化蛋白调控纳米晶体分子机制基础上,综合了无机纳米载体和蛋白质载体这两种重要药物递送系统的优点,成功设计合成安全且高效的纳米鱼雷状的新型化疗药物递送平台,相关成果发表在国际期刊Chemical Engineering Journal上。
安全且高效的化疗药物递送系统可以有效延长药物的半衰期,提高药效,减少其毒副作用。近年来,基于脂质体药物载体开发的化疗药物如Doxil(阿霉素脂质体)和Onivyd(伊立替康脂质体)已广泛应用于临床。但是由于脂质体类药物载体结构组装松散,稳定性较差,化疗药物在血液循环中十分容易泄漏,不仅导致病变区域的蓄积量低,而且潜在的心脏毒性风险高。随着纳米技术的快速发展,基于无机纳米颗粒的开发化疗药物载体可以有效地稳定化疗药物,提高载药效率,延长血液循环中的半衰期并且可以赋予药物综合诊断和治疗的能力。另外,基于蛋白质的开发化疗药物载体具有良好的生物相容性和生物降解性,易于修饰,可提高药物稳定性,降低或消除免疫原性和副作用。然而,这两种递送系统仍有其自身的局限性,主要表现为无机纳米颗粒的生物毒性和蛋白质载体的载药效率较低。因此,同时结合无机纳米颗粒和蛋白质载体的优势是一个重要策略来优化药物输送系统。
受生物矿化过程的启发,利用生物大分子(蛋白质)进行仿生合成已成为构建具有高生物相容性和稳定性的有机-无机复合材料的重要方法。基于此前课题组相关研究的基础(Journal of Materials Chemistry B, 2017, 5(16): 2888-2895;ACS Applied Materials & Interfaces, 2020, 12(51): 56701-56711;PNAS,2022,Vol. 119 No. 45),团队成功地利用矿化BSA蛋白仿生合成体系实现无机纳米与蛋白有机结合,构建出白蛋白-磁铁矿纳米鱼雷药物载体,实现了疏水化疗药物阿霉素的高效装载。新型纳米鱼雷药物载体由白蛋白与四氧化三铁组成,具有极佳的生物兼容性,可以被生物体高效吸收和降解。多项的体外与体内实验数据表明新型载体兼顾了无机纳米和蛋白载体的优势,有效地解决了疏水性小分子化疗药物的泄露问题,延长了血液循环中的半衰期,完成了药物高效定点胞内运送和肿瘤抑制。除此以外,基于透射电镜、分子动力学模拟和计算模型,团队提出了蛋白质-药物-纳米颗粒复合纳米鱼雷的复杂分子结构。研究结果证实了阿霉素(Dox)包封稳定性的结构基础,揭示了纳米鱼雷作为药物载体的构效关系,拓展了药物传递系统的研究范围。
强磁场中心博士生赵享龙和博士后许帅为该论文的共同第一作者,强磁场中心王俊峰研究员和马坤助理研究员为文章的通讯作者。该项研究获得国家自然科学基金、科技部重大专项、中科院合肥研究院院长基金以及国家重大科技基础设施“稳态强磁场实验装置”(SHMFF)的支持。
文章链接:https://doi.org/10.1016/j.cej.2022.140440
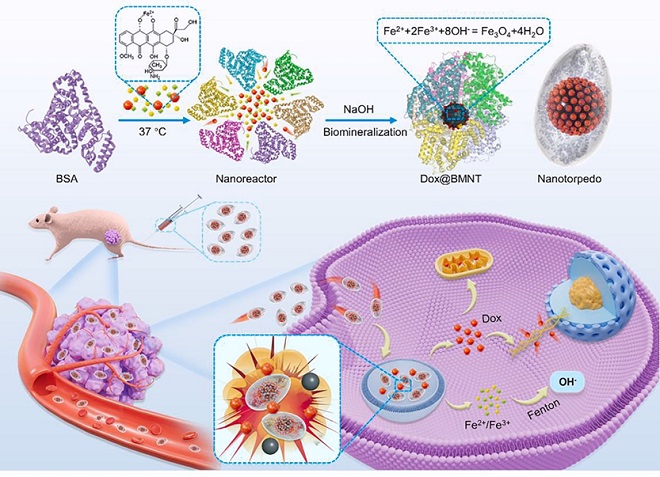
图.新型纳米鱼雷药物递送平台具有极高生物兼容性和结构稳定性有效提高药物装载效率与药效
