近日,中科院强磁场科学中心王俊峰研究员课题组与Texas A&M University的黄韵教授、周育斌教授课题组合作,研发了一种能够利用可见光在纳米尺度上精确调控细胞器之间连接的新型光遗传学工具。该工作以Optical Control of Membrane Tethering and Interorganellar Communication at Nanoscales为题,作为封面文章发表于英国皇家化学学会顶级科技期刊Chemical Science(Chem. Sci., 2017,8, 5275-5281)。
内质网是真核细胞内重要的细胞器,是由双层膜组成的腔体结构。它与细胞内其它各种不同的膜组分(质膜、线粒体膜等)有着动态的相互作用和信息交流,形成了一个巨大的细胞内膜网络。内质网与质膜之间,通过内质网上的膜蛋白识别质膜内侧特异性分布的磷脂肌醇,形成距离为10-40纳米的膜接触位点(membrane contact site)。膜接触位点在膜运输、钙离子稳态和脂代谢等许多细胞生理过程中发挥了非常重要的作用,是近年来的一个新兴研究热点。但由于缺乏有效的实验工具,对膜接触位点形成机理和功能的研究十分有限。
光遗传学是利用光学和遗传学来控制蛋白活性和细胞功能的一项生物学技术,具有得天独厚的优势,例如光遗传学的可操作性好、实时可逆,定位精准、对细胞组织无创伤等等。为了更好研究膜接触位点的功能,两个课题组开发了一种用蓝光调控,可在细胞质与质膜之间穿梭的光遗传学工具—OptoPB。OptoPB是一个主要由光敏蛋白LOV2和Polybasic(PB)domains组成的融合蛋白。在黑暗中,N端的LOV2像一把锁,将C端的PB蛋白锁定在核心结构上。经过蓝光照射,LOV2末端的Jα螺旋在几秒内被解构打开,将PB蛋白释放。因PB蛋白富含精氨酸、赖氨酸之类的碱性氨基酸可以与质膜内侧带酸性的磷酸肌醇磷脂PI(4,5)P2和/或PI(3,4,5)P3发生相互作用,从而把蛋白锚定至质膜。撤去光照之后,OptoPB可以在1分钟内迅速从质膜上回落并弥散在细胞质中。
利用核磁共振和分子动力学模拟手段对黑暗条件下的OptoPB蛋白建模后,课题组发现LOV2表面有两个带有负电荷的结合口袋,可以很好地将具有强正电荷的PB蛋白限制在LOV2核心结构域上,从而不与质膜发生结合。在光照条件下,OptoPB能够迅速地转移至质膜附近。整个穿梭过程可以通过明暗交替操作达到可逆控制。为了进一步调控内质网与质膜的膜接触位点的形成,两个课题组合作在OptoPB的N端插入了内质网膜定位的序列,形成了内质网跨膜蛋白OptoPBer。同时为了精确地调控内质网与质膜之间形成的膜接触位点的距离,在OptoPBer与跨膜区之间加入了不同数量的(EAAAR)4n α-螺旋序列(n=1-8)。在蓝光照射下,由于插入(EAAAR)4数量的不同,可以有效地控制内质网与细胞膜之间形成约为10至40纳米的空间距离。利用此项独特的设计,两个课题组在纳米数量级成功地实现了用蓝光来遥控内质网和质膜接触位点的间距,并控制其相关的功能。
该研究的意义在于可以通过光这种非侵入性、在时间与空间上具有高度可操作性的刺激源,来完成蛋白质的亚细胞定位高效、可逆的控制蛋白质的亚细胞定位、磷酸肌醇磷脂代谢以及细胞内膜系统之间的接触位点的形成。这一实验技术摆脱了传统实验技术手段的束缚,让复杂、难以调控的生命活动,可在蓝光的控制下模拟进行,具有十分广泛的应用前景。同样的,光遗传学蛋白质工程方法可以进一步拓展至其它亚细胞器之间膜接触位点的研究。为研究者调节蛋白与膜相互作用、膜与膜之间细胞信号通路转导等提供了新型有效的技术手段。
强磁场科学中心王俊峰课题组博士后朱磊和Texas A&M University的周育斌课题组博士研究生何涟、荆吉是该文章的共同第一作者,王俊峰研究员、周育斌教授和黄韵教授为共同通讯作者。该研究得到了国家自然科学基金、中国科技部、中国国家留学基金委项目的资助,部分实验依托稳态强磁场大科学实验装置完成。
文献链接:http://pubs.rsc.org/en/content/articlelanding/2017/sc/c7sc01115f

Chem. Sci., 2017,8, 封面,展示OptoPB蛋白在光照下与质膜结合
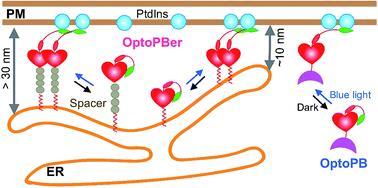
OptoPB和OptoPBer的设计原理和应用
