近日,中科院合肥研究院刘青松研究员课题组和刘静研究员课题组在针对FLT3-ITD突变选择性的激酶小分子抑制剂研究方面取得新进展,发现了成药性良好的第三代抑制剂CHMFL-FLT3-362。目前该成果在线发表于国际学术期刊Haematologica。
急性髓性白血病(AML)是由于髓性细胞通过克隆、增殖、异常分化等方式快速渗透至骨髓,血液和其他组织(脾、淋巴结、肝脏等)而引起的造血系统异常的癌症,是成年人最常见的急性白血病,其发病率随年龄增加,且病人生存率较低。研究表明,30%的AML与FLT3激酶突变相关。目前已有若干个FLT3激酶抑制剂被批准用于治疗FLT3-ITD阳性的AML,但这些小分子抑制剂均对野生型FLT3和cKIT激酶具有强烈的抑制作用,在临床上会导致骨髓抑制毒性,并能引发毛发白化病等副作用。正常的野生型FLT3激酶主要在人的骨髓细胞、早期祖细胞、树突状细胞祖细胞和CD34+的造血干细胞中表达,在造血干细胞和祖细胞的增殖和分化中起着重要的作用。因此,为了避免抑制正常野生型FLT3及cKIT激酶所带来的不良影响,开发选择性针对FLT3-ITD突变的小分子抑制剂具有重要的临床价值。
在前期研究中,研究团队已针对FLT3-ITD阳性的急性白血病开发了一系列具有自主知识产权的小分子抑制剂,包括第一代高选择性的FLT3激酶抑制剂HYML-122(目前处于临床I期)、第二代能够克服多种耐药突变的II型激酶抑制剂CHMFL-FLT3-213,以及首个第三代针对FLT3-ITD突变的抑制剂CHMFL-FLT3-335。为了进一步提高其活性、选择性及成药性,研究团队利用计算机辅助药物设计的方法,通过结构优化发展了新型第三代抑制剂CHMFL-FLT3-362。
在蛋白、细胞、动物层次上的研究表明,CHMFL-FLT3-362除了进一步提高了在FLT3-ITD与wt-FLT3等激酶间的选择性之外,与已上市的FLT3抑制剂米哚妥林(Midostaurin)相比,能够显著降低斑马鱼模型的尾部畸形的出现。在连续给药14天的小鼠模型实验中,也没有引起明显的骨髓抑制毒性。这些实验结果进一步验证了FLT3-ITD突变选择性的小分子抑制剂在临床应用上可能具有更好的安全性。此外,CHMFL-FLT3-362在SD大鼠、KM小鼠及Beagle犬中表现出良好的药物代谢动力学性质。在动物体内药效评价方面,在MV4-11细胞皮下移植瘤的小鼠模型上,CHMFL-FLT3-362在150 mg/kg/day的剂量下的抑瘤率(TGI)高达95%,并且在MV4-11细胞原位瘤的小鼠模型上能够显著延长动物的生存时间。
该研究成果获得了国家自然科学基金、中科院“个性化药物”先导专项、中科院青促会、博士后基金特别资助等项目的支持。
文章链接:http://www.haematologica.org/content/early/2020/04/16/haematol.2019.244186.full.pdf+html
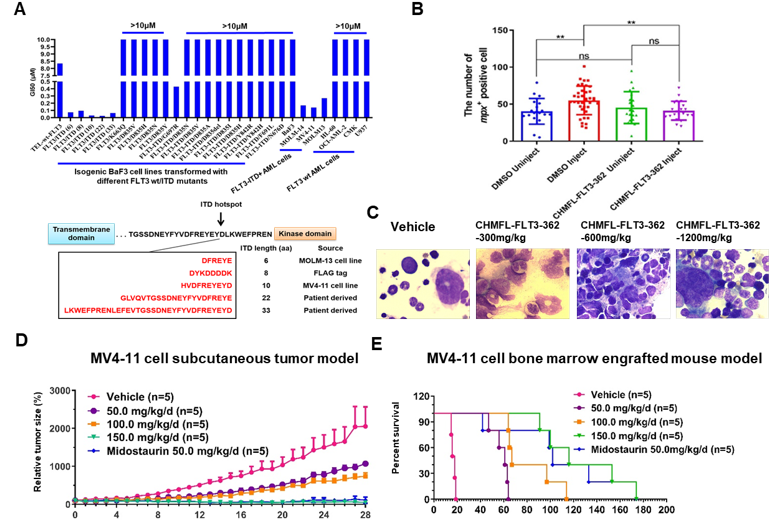
CHMFL-FLT3-362的作用机制及药效数据
