近期,中科院合肥研究院强磁场科学中心王俊峰课题组在利用液体核磁共振技术研究蛋白质相互作用领域取得进展。该研究揭示了人源Vav2蛋白与细胞膜磷脂以及受体酪氨酸激酶EphA2近膜区的选择性识别机制,并发现磷脂双层膜环境对蛋白-蛋白相互作用的影响。相关研究成果以“Biochemical and NMR characterization of the interactions of Vav2-SH2 domain with lipids and the EphA2 juxtamembrane region on membrane”为题发表在国际期刊Biochemical Journal杂志上。
蛋白质在体内通过与其它分子的相互作用发挥功能,包括:蛋白质、磷脂、核酸等。液体核磁共振技术可以在原子层次,近生理条件下研究蛋白质相互作用。Vav2蛋白是Rho家族小GTP酶的鸟苷酸交换因子(GEF),催化Rho GTP酶的活化。Vav2在人体内广泛分布,参与调控细胞迁移,血管生成,神经发育等重要生理过程。研究表明Vav2可以通过其SH2结构域特异识别Ephrins受体、表皮生长因子受体(EGFR)等多种细胞表面受体的胞内区酪氨酸磷酸化位点,进而被招募到细胞膜上并介导不同细胞信号转导。
在该项工作中,研究人员揭示了Vav2-SH2结构域能够利用其传统的蛋白结合位点与EphA2 近膜区(EphA2-JM)Y594磷酸化位点特异结合。同时,还发现Vav2-SH2不仅可以介导蛋白-蛋白识别,还具有磷脂分子识别功能,能够特异性识别磷脂PI(4,5)P2和PI(3,4,5)P3。核磁共振实验确定了其磷脂结合位点,该位点独立于其蛋白结合位点。进一步,研究人员应用磷脂纳米盘(nanodiscs)来模拟细胞磷脂双层膜,研究了Vav2-SH2与膜锚定的EphA2 近膜区的相互作用,发现膜环境提高了Vav2-SH2与EphA2-JM的结合亲和力,表明了生物膜调控蛋白-蛋白相互作用的重要性。该研究为在近生理条件下,磷脂双层膜环境中研究蛋白-蛋白相互作用提供了一种思路。
该项研究获得国家自然科学基金和国家重点研发项目的支持。所有核磁共振实验均在稳态强磁场实验装置的核磁共振谱仪系统上完成。
文章链接:https://portlandpress.com/biochemj/article/477/19/3791/226367/
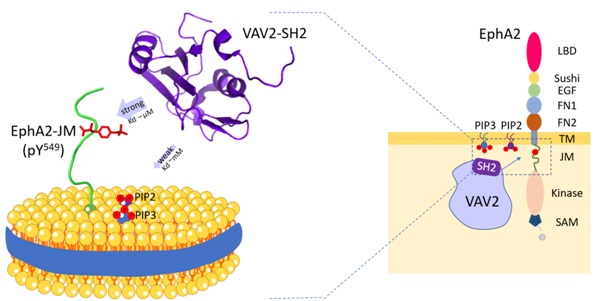
Vav2-SH2 蛋白与磷脂及EphA2-JM结合的示意图
